|
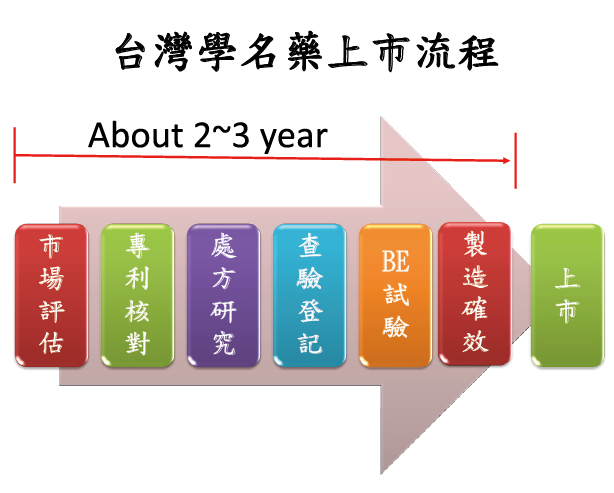
↑學名藥上市流程。
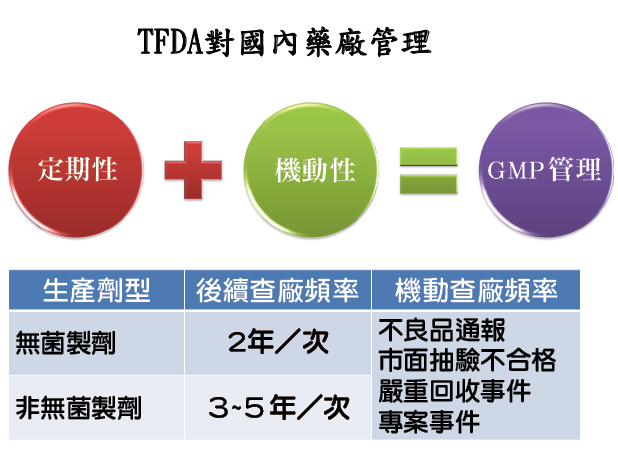
↑TFDA對國內藥廠管理。
◎文/詹明昇
「學名藥」乃是藥品專利期過後該藥品能證明其品質、安全與療效無虞,且與已核准之藥品具同成分、同劑型、同劑量、同療效之製劑。為確保學名藥的安全性和療效,衛福部食藥署於上市前會依據國際醫藥法規協和會(International
Council for Harmonisation of Technical Requirements for
Pharmaceuticals for Human Use, ICH)規範進行審查,同時透過藥品生體相等性(BE)試驗來證明具有相同療效。
學名藥除藥品需要具備相同療效外,其製造廠亦需符合國際醫藥品稽查協約組織之藥品優良製造規範(簡稱PIC/S GMP)下運作。然而,為確保藥品符合上市許可之要求,食藥署會對藥廠實施定期或不定期查核,以確認製藥品質系統能有效運作。
隨著台灣製藥GMP法規及藥政管理國際化,國內生產的學名藥品質無虞且應該獲得國人認同,以往認為只有原廠藥才有效之錯誤觀念需要逐漸被導正。
目前國內藥廠依據PIC/S GMP規範進行,在GMP管理上與以往有所不同,基本包含:
1. 生產批次紀錄及樣品保留到效期後一年。
2. 品保部門需獨立於生產部門。
3. 有效的變更管理及審查機制確保符合上市時的品質。
4. 每年對所有產品進行一次品質回顧。
5. 每一單位包裝原料須執行鑑別。
6. 每年至少執行一批持續性安定性試驗。
7. 應制定產品回收機制,並每年進行回收模擬。
8. 建立原材料合格供應商評估機制。
9. 所有數據需符合數據完整性(DI)規定。
國內GMP法規隨時代轉變不斷更新,藥品品質管理也從「品質是檢驗出來」、「品質是製造出來」、「品質是設計出來」,一直演變到「品質是系統建立出來」。學名藥廠的品質管理系統隨著法規要求持續改善與進步,同時供應台灣廣大藥品市場,例如,2023年COVID-19疫情後抗感染製劑(Anti-infective
agents)全球性的缺藥風波,許多第一線抗生素原廠無法順利輸入下,需仰賴國內藥廠合作增加供應量才得以緩解藥品短缺問題。在國內GMP制度日趨完善的情況下,國內學名藥廠之改變與貢獻應該值得台灣民眾認同,因此盼望國內法規及健保制度持續改善,鼓勵國產學名藥的生產,進而達到穩定供應藥品為常態,使國產學名藥在台灣得以永續經營以嘉惠國人保障用藥的權益。
(本文作者為中化製藥副總經理)
回首頁 |