|
◎文/藥師黃鈺琳
由阿斯特捷利康(AstraZeneca)與第一三共(Daiichi Sankyo)共同研發的乳癌新標靶藥ENHERTU®(Trastuzumab
deruxtecan) 100 mg/vail於2022年7月19日通過歐盟(EU)核准用於HER2陽性之無法切除或轉移性乳癌,同年8月5日獲得美國食品藥物管理局(FDA)核准用於治療完成輔助化療或六個月內發生轉移的HER2低表現性(HER2-low)乳癌患者。衛福部核可適應症:單獨使用適用於治療轉移後曾接受過兩種以上抗HER2療程、具有無法切除或轉移性HER2陽性乳癌的成人病人。
用法用量
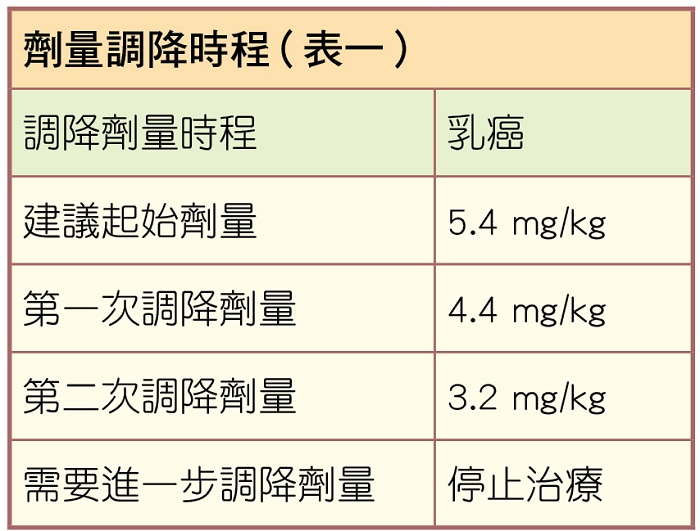
ENHERTU®的建議劑量為5.4 mg/kg,每三週以靜脈輸注給藥,直到疾病惡化或發生無法耐受的毒性為止。
不良反應的處置可能包含暫時中斷治療、調降劑量(表一)或停止ENHERTU®治療,調降劑量後不應再調升ENHERTU®劑量。年滿65歲以上的病人不需要調整,尚未確立在兒童與未滿18歲青少年中的安全性與療效,因無兒童族群之相關使用經驗。
常見的不良反應(頻率≧20%)
噁心(79.9%)、疲倦(60.3%)、嘔吐(48.7%)、掉髮(46.2%)、便祕(35.9%)、食慾減退(34.6%)、貧血(33.8%)、嗜中性白血球減少症(32.5%)、腹瀉(30.8%)、血小板減少症(23.1%)、咳嗽(21.4%)、白血球減少症(20.5%)與頭痛(20.1%)。
警語
1.ENHERTU®不可與trastuzumab或trastuzumab emtansine相互替代。
2.肺毒性:ENHERTU®使用中應監測徵兆及症狀如咳嗽、呼吸困難、發燒及其他新發生或惡化的呼吸道症狀。如有發生第2級以上間質性肺炎(ILD)/肺炎,請永久停藥。
3.左心室功能不全:應在初次施用ENHERTU®之前,及在治療期間視臨床需求定期評估左心室射出分率(LVEF)。若發生LVEF降低應先中斷治療進行處理。若確認LVEF低於40%,或相較於基期的絕對下降量大於20%,應永久停用ENHERTU®。若發生鬱血性心臟衰竭(CHF)的病人,應永久停用ENHERTU®。
結語
ENHERTU®為乳癌患者帶來新的治療選擇,對於曾接受過其他治療失敗的轉移性HER2乳癌患者仍有顯著療效,帶給HER2陽性的乳癌患者更好的存活與預後。
參考資料
1.ENHERTU®藥品仿單(2021年12月訂製)
2.UpToDate:Access Lexicomp Online for additional drug information
3.Micromedex
(本文作者為高雄長庚藥劑部藥師)
回首頁 |