
↑健保給付條件與公告內容。
◎文╱台中記者張智誠
Dacomitinib(VizimproⓇ,肺欣妥)是第二代的表皮生長因子受體酪胺酸酶抑制劑(epidermal growth factor receptor - tyrosine kinase inhibitor,EGFR-TKI),107年9月美國FDA基於ARCHER 1050臨床試驗的優異結果核准dacomitinib。108年12月台灣FDA核准dacomitinib,核准的適應症為:帶有EGFR突變之局部晚期或轉移性非小細胞肺癌成人病人的第一線治療。
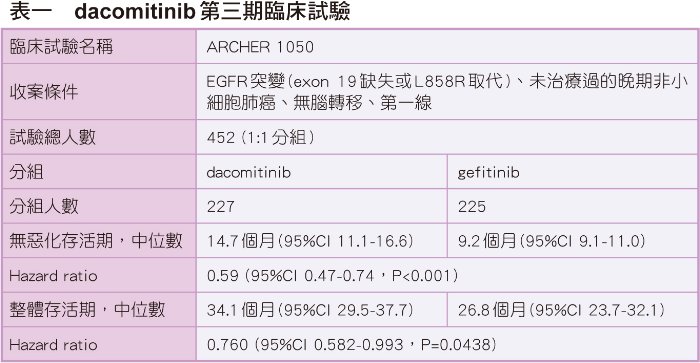
ARCHER 1050是一項全球性、多中心、開放性的第三期臨床試驗,收入452位EGFR突變(exon 19缺失或L858R取代)、無腦轉移、未治療過的晚期非小細胞肺癌受試者,其中亞裔族群佔77%,受試者隨機接受dacomitinib 45 mg QD或gefitinib 250 mg QD治療,試驗終點為無惡化存活期。
在安全性方面,dacomitinib組最常發生的副作用為腹瀉、甲溝炎、痤瘡樣皮疹、口腔炎;gefitinib組最常發生的副作用為腹瀉、肝指數升高。三到五級嚴重副作用的發生率在dacomitinib組與gefitinib組分別為63%與41%;三級以上痤瘡樣皮疹在dacomitinib組的發生率為14%、gefitinib組為0%;三級以上腹瀉在dacomitinib組的發生率為8%、gefitinib組為1%;三級以上肝指數升高在dacomitinib組的發生率為1%、gefitinib組為8%。
Dacomitinib組與gefitinib組因不良事件退出試驗的比例分別為10%及7%。值得注意的是,因副作用而必須調降劑量的比率在dacomitinib組與gefitinib組分別是66%與8%,dacomitinib組有很高的比率必須調整劑量。
健保將於109年10月1日開始有條件給付dacomitinib,45mg、30mg與15mg健保價皆為1128元。Dacomitinib適用於EGFR-TK Exon 19 Del或Exon 21 L858R點突變,且無腦轉移之局部侵犯性或轉移性肺腺癌病人之第一線治療,每次處方以四週為限。
(本文作者為亞洲大學附屬醫院藥劑科藥師)
回首頁 |